sur Heidelberg Pharma AG (ETR:HPHA)
Le HDP-101 de Heidelberg Pharma reçoit la désignation accélérée de la FDA
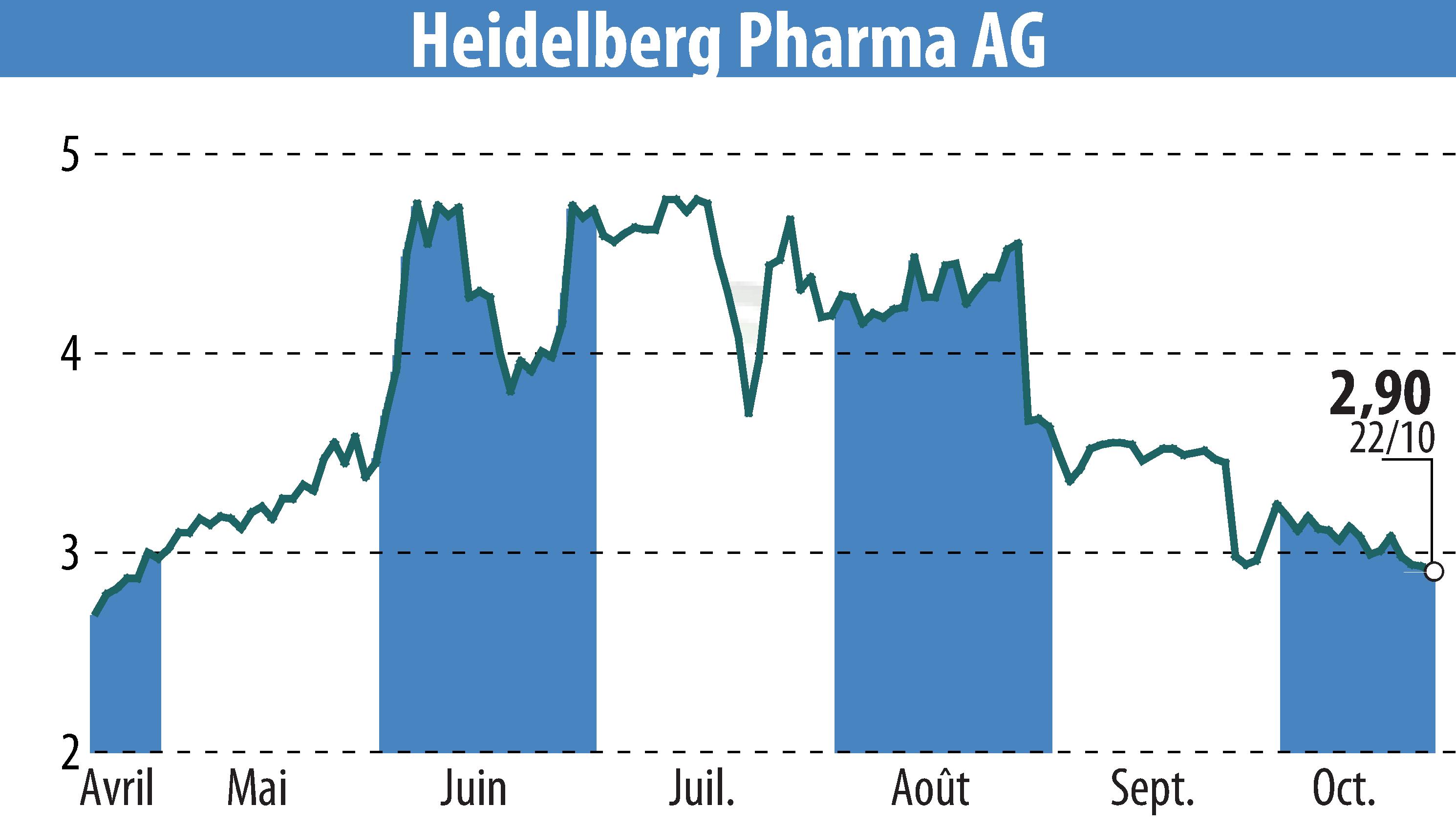
Heidelberg Pharma AG a annoncé que son principal candidat CAM, le HDP-101, a obtenu la désignation « Fast Track » de la FDA américaine pour le traitement du myélome multiple. Cette désignation souligne le potentiel du HDP-101 à répondre à d'importants besoins médicaux non satisfaits dans le traitement de maladies graves.
Le statut Fast Track permet des interactions plus fréquentes avec la FDA et un processus d'évaluation évolutif, ce qui pourrait accélérer le développement et l'évaluation. Cette désignation repose sur des données cliniques préliminaires et non cliniques encourageantes issues d'une étude de phase I/IIa en cours évaluant l'innocuité et l'activité antitumorale du HDP-101.
Le HDP-101 (DCI : pamlectabart tismanitin) est toujours en cours d'investigation et n'a pas encore reçu d'autorisation de mise sur le marché. Heidelberg Pharma reste déterminé à développer ce candidat prometteur afin d'offrir de nouvelles options thérapeutiques aux patients atteints de myélome multiple récidivant ou réfractaire.
R. P.
Copyright © 2026 FinanzWire, tous droits de reproduction et de représentation réservés.
Clause de non responsabilité : bien que puisées aux meilleures sources, les informations et analyses diffusées par FinanzWire sont fournies à titre indicatif et ne constituent en aucune manière une incitation à prendre position sur les marchés financiers.
Cliquez ici pour consulter le communiqué de presse ayant servi de base à la rédaction de cette brève
Voir toutes les actualités de Heidelberg Pharma AG
