sur THERACLION (EPA:ALTHE)
Theraclion soumet Sonovein à la FDA après d'importants progrès
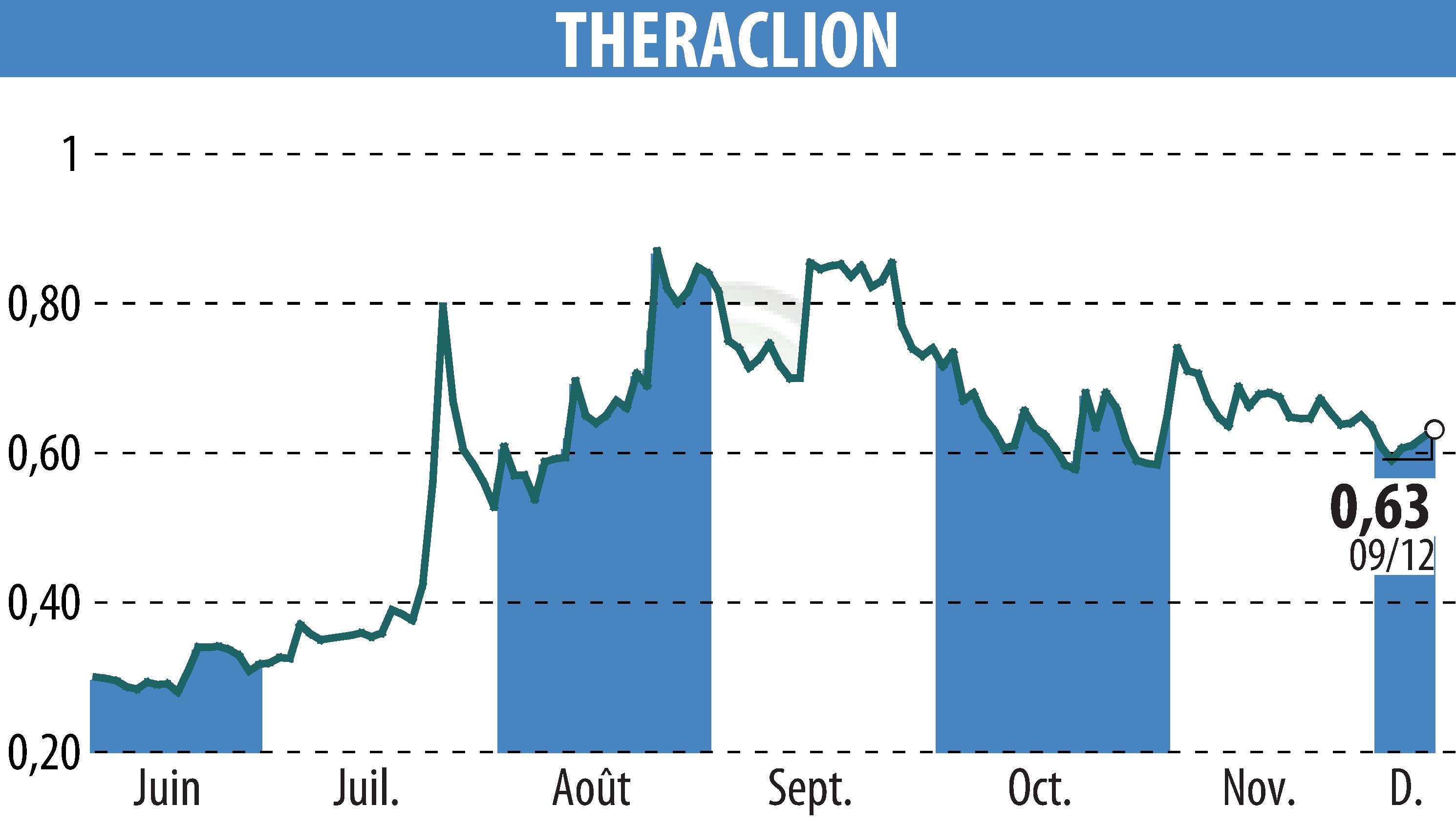
Le 9 décembre 2025, Theraclion a annoncé la soumission de son dispositif Sonovein® à la FDA. Cette demande de clearance De Novo pourrait voir une décision arriver mi-2026. Une approbation permettrait l'entrée de Sonovein® sur le marché américain, le plus grand pour le traitement des varices.
En 2025, Sonovein® a reçu la certification MDR en Europe et a satisfait la norme chinoise GB 9706.1-2020. Des publications scientifiques ont confirmé son efficacité, notamment des études montrant jusqu'à 97 % d'efficacité à 12 mois.
La présence de Theraclion à 16 congrès a renforcé sa visibilité auprès des spécialistes. La proposition de valeur de Sonovein®, combinée à son efficacité, a été bien reçue.
R. E.
Copyright © 2026 FinanzWire, tous droits de reproduction et de représentation réservés.
Clause de non responsabilité : bien que puisées aux meilleures sources, les informations et analyses diffusées par FinanzWire sont fournies à titre indicatif et ne constituent en aucune manière une incitation à prendre position sur les marchés financiers.
Cliquez ici pour consulter le communiqué de presse ayant servi de base à la rédaction de cette brève
Voir toutes les actualités de THERACLION
